ອົງການ FDA ໄດ້ອອກແຈ້ງການທີ່ມີຫົວຂໍ້ວ່າ "ການລົງທະບຽນ ແລະ ລາຍຊື່ອຸປະກອນ" ໃນເວັບໄຊທ໌ທາງການຂອງຕົນໃນວັນທີ 23 ມິຖຸນາ, ເຊິ່ງເນັ້ນໜັກວ່າ:
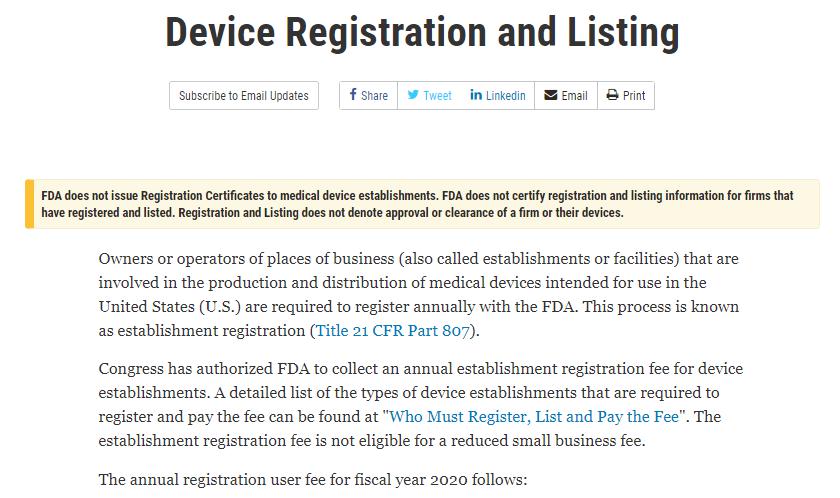
ອົງການ FDA ບໍ່ໄດ້ອອກໃບຢັ້ງຢືນການລົງທະບຽນໃຫ້ແກ່ສະຖານທີ່ຜະລິດອຸປະກອນການແພດ. ອົງການ FDA ບໍ່ໄດ້ຮັບຮອງການລົງທະບຽນ ແລະ ການລົງທະບຽນ
ຂໍ້ມູນສຳລັບບໍລິສັດທີ່ໄດ້ລົງທະບຽນ ແລະ ຈົດທະບຽນແລ້ວ. ການລົງທະບຽນ ແລະ ການລົງທະບຽນບໍ່ໄດ້ໝາຍເຖິງການອະນຸມັດ ຫຼື ການອະນຸມັດຂອງບໍລິສັດ
ຫຼື ອຸປະກອນຂອງເຂົາເຈົ້າ.
ບັນຫາທີ່ພວກເຮົາຕ້ອງເອົາໃຈໃສ່ໃນການລົງທະບຽນ FDA ມີດັ່ງນີ້:
ຄຳຖາມທີ 1: ອົງການໃດທີ່ອອກໃບຢັ້ງຢືນ FDA?
ກ: ບໍ່ມີໃບຢັ້ງຢືນການລົງທະບຽນ FDA. ຖ້າຜະລິດຕະພັນໄດ້ລົງທະບຽນກັບ FDA, ຈະໄດ້ຮັບເລກທະບຽນ. FDA ຈະໃຫ້ຈົດໝາຍຕອບກັບຜູ້ສະໝັກ (ເຊັນໂດຍຜູ້ບໍລິຫານຂອງ FDA), ແຕ່ບໍ່ມີໃບຢັ້ງຢືນ FDA.
ການປະກາດແຈ້ງການດັ່ງກ່າວຂອງ FDA ໃນເວລານີ້ເປັນການເຕືອນທີ່ເຂັ້ມແຂງ! ເນື່ອງຈາກການພັດທະນາສະຖານະການການລະບາດໃນສະຫະລັດໃນໄລຍະມໍ່ໆມານີ້, ຄວາມຕ້ອງການຜະລິດຕະພັນປ້ອງກັນການລະບາດທາງການແພດທີ່ສົ່ງອອກໄປສະຫະລັດໄດ້ເພີ່ມຂຶ້ນຢ່າງຫຼວງຫຼາຍ, ແລະຄວາມຕ້ອງການການລົງທະບຽນສົ່ງອອກກໍ່ເພີ່ມຂຶ້ນເຊັ່ນກັນ.
ເມື່ອບາງວິສາຫະກິດປອມຕົວເປັນ FDA ເພື່ອອອກໃບຢັ້ງຢືນໃຫ້ຜູ້ຜະລິດ, ບາງວິສາຫະກິດຈໍາໜ່າຍອາດຈະໄດ້ຮັບ “ໃບຢັ້ງຢືນ FDA” ປອມເມື່ອປຶກສາກັບຜູ້ຜະລິດ.
ຄຳຖາມທີ 2: FDA ຕ້ອງການຫ້ອງທົດລອງທີ່ໄດ້ຮັບການຮັບຮອງບໍ?
ກ: FDA ເປັນອົງການບັງຄັບໃຊ້ກົດໝາຍ, ບໍ່ແມ່ນອົງການບໍລິການ. ຖ້າຜູ້ໃດຜູ້ໜຶ່ງເວົ້າວ່າພວກເຂົາເປັນຫ້ອງທົດລອງຮັບຮອງຂອງ FDA, ຢ່າງໜ້ອຍພວກເຂົາກໍ່ເຮັດໃຫ້ຜູ້ບໍລິໂພກເຂົ້າໃຈຜິດ, ເພາະວ່າ FDA ບໍ່ມີການບໍລິການສາທາລະນະ.
ອົງການຮັບຮອງເພດ ແລະ ຫ້ອງທົດລອງ, ບໍ່ມີສິ່ງທີ່ເອີ້ນວ່າ "ຫ້ອງທົດລອງທີ່ຖືກກຳນົດ". ໃນຖານະທີ່ເປັນອົງການບັງຄັບໃຊ້ກົດໝາຍຂອງລັດຖະບານກາງ, FDA ບໍ່ຄວນມີສ່ວນຮ່ວມໃນສິ່ງຕ່າງໆເຊັ່ນ: ການເປັນທັງຜູ້ຕັດສິນ ແລະ ນັກກິລາ. FDA ຈະທົດສອບການບໍລິການເທົ່ານັ້ນ
ຄຸນນະພາບ GMP ຂອງຫ້ອງທົດລອງຈະໄດ້ຮັບການຍອມຮັບ, ແລະ ຫ້ອງທົດລອງທີ່ມີຄຸນວຸດທິຈະໄດ້ຮັບໃບຢັ້ງຢືນພ້ອມກັບໃບຢັ້ງຢືນ, ແຕ່ມັນຈະບໍ່ຖືກ "ກຳນົດ" ຫຼື ແນະນຳໃຫ້ສາທາລະນະຊົນ.
ຄຳຖາມທີ 3: ການລົງທະບຽນ FDA ຕ້ອງການຕົວແທນສະຫະລັດບໍ?
ກ: ແມ່ນແລ້ວ, ວິສາຫະກິດຕ້ອງແຕ່ງຕັ້ງພົນລະເມືອງສະຫະລັດ (ບໍລິສັດ/ສະມາຄົມ) ເປັນຕົວແທນເມື່ອລົງທະບຽນກັບ FDA. ຕົວແທນມີໜ້າທີ່ຮັບຜິດຊອບຕໍ່ການບໍລິການຂະບວນການທີ່ຕັ້ງຢູ່ໃນສະຫະລັດ, ເຊິ່ງເປັນສື່ທີ່ຈະຕິດຕໍ່ FDA ແລະ ຜູ້ສະໝັກ.
ຄວາມຜິດພາດທົ່ວໄປໃນການລົງທະບຽນ FDA
1. ການລົງທະບຽນ FDA ແຕກຕ່າງຈາກການຮັບຮອງ CE. ຮູບແບບການຮັບຮອງຂອງມັນແຕກຕ່າງຈາກຮູບແບບໃບຢັ້ງຢືນການທົດສອບຜະລິດຕະພັນ + ການລາຍງານການຮັບຮອງ CE. ການລົງທະບຽນ FDA ຕົວຈິງແລ້ວໃຊ້ຮູບແບບການປະກາດຄວາມຊື່ສັດ, ນັ້ນຄື, ທ່ານມີຮູບແບບການປະກາດດ້ວຍຄວາມຊື່ສັດສຳລັບຜະລິດຕະພັນຂອງທ່ານເອງ.
ອີງຕາມມາດຕະຖານ ແລະ ຂໍ້ກຳນົດດ້ານຄວາມປອດໄພທີ່ກ່ຽວຂ້ອງ, ແລະ ໄດ້ລົງທະບຽນໃນເວັບໄຊທ໌ຂອງລັດຖະບານກາງສະຫະລັດ, ຖ້າມີອຸບັດຕິເຫດເກີດຂຶ້ນກັບຜະລິດຕະພັນ, ຜະລິດຕະພັນນັ້ນຕ້ອງຮັບຜິດຊອບຕາມທີ່ສອດຄ້ອງກັນ. ດັ່ງນັ້ນ, ການລົງທະບຽນຂອງ FDA ສຳລັບຜະລິດຕະພັນສ່ວນໃຫຍ່, ຈຶ່ງບໍ່ມີການສົ່ງຕົວຢ່າງການທົດສອບ.
ແລະໃບປະກາດສະນີຍະບັດ.
2. ໄລຍະເວລາຂອງການລົງທະບຽນ FDA: ການລົງທະບຽນ FDA ມີອາຍຸໜຶ່ງປີ. ຖ້າມັນຫຼາຍກວ່າໜຶ່ງປີ, ມັນຕ້ອງໄດ້ຍື່ນເພື່ອລົງທະບຽນຄືນໃໝ່, ແລະ ຄ່າທຳນຽມປະຈຳປີທີ່ກ່ຽວຂ້ອງກໍ່ຕ້ອງໄດ້ຈ່າຍອີກຄັ້ງ.
3. FDA ໄດ້ລົງທະບຽນດ້ວຍໃບຢັ້ງຢືນບໍ?
ໃນຄວາມເປັນຈິງ, ບໍ່ມີໃບຢັ້ງຢືນສຳລັບການລົງທະບຽນ FDA. ຖ້າຜະລິດຕະພັນໄດ້ລົງທະບຽນກັບ FDA, ເລກທະບຽນຈະໄດ້ຮັບ. FDA ຈະໃຫ້ຈົດໝາຍຕອບກັບຜູ້ສະໝັກ (ເຊັນໂດຍຫົວໜ້າບໍລິຫານຂອງ FDA), ແຕ່ບໍ່ມີໃບຢັ້ງຢືນ FDA.
ໃບຢັ້ງຢືນທີ່ພວກເຮົາເຫັນໂດຍປົກກະຕິແມ່ນອອກໂດຍອົງການຕົວກາງ (ຕົວແທນລົງທະບຽນ) ໃຫ້ແກ່ຜູ້ຜະລິດເພື່ອພິສູດວ່າມັນໄດ້ຊ່ວຍໃຫ້ຜູ້ຜະລິດເຮັດສຳເລັດ “ການລົງທະບຽນສະຖານທີ່ຜະລິດ ແລະ ການລົງທະບຽນປະເພດຜະລິດຕະພັນ” ຕາມທີ່ FDA ກຳນົດ.
(ການລົງທະບຽນສະຖາບັນ ແລະ ລາຍຊື່ອຸປະກອນ), ເຄື່ອງໝາຍທີ່ສຳເລັດແລ້ວແມ່ນເພື່ອຊ່ວຍໃຫ້ຜູ້ຜະລິດໄດ້ຮັບເລກທະບຽນ FDA.
ອີງຕາມລະດັບຄວາມສ່ຽງທີ່ແຕກຕ່າງກັນ, FDA ແບ່ງອຸປະກອນການແພດອອກເປັນສາມປະເພດ (I, II, III), ແລະຊັ້ນ III ມີລະດັບຄວາມສ່ຽງສູງສຸດ.
ອົງການ FDA ໄດ້ກຳນົດຢ່າງຈະແຈ້ງກ່ຽວກັບການຈັດປະເພດຜະລິດຕະພັນ ແລະ ຂໍ້ກຳນົດການຄຸ້ມຄອງສຳລັບອຸປະກອນການແພດແຕ່ລະຊະນິດ. ໃນປະຈຸບັນ, ມີລາຍການອຸປະກອນການແພດຫຼາຍກວ່າ 1700 ຊະນິດ. ຖ້າອຸປະກອນການແພດໃດຕ້ອງການເຂົ້າສູ່ຕະຫຼາດສະຫະລັດ, ກ່ອນອື່ນໝົດອົງການ FDA ຕ້ອງຊີ້ແຈງຂໍ້ກຳນົດການຈັດປະເພດ ແລະ ການຄຸ້ມຄອງຂອງຜະລິດຕະພັນທີ່ນຳໃຊ້ສຳລັບການຕະຫຼາດ.
ຫຼັງຈາກຊີ້ແຈງຂໍ້ມູນຂ້າງເທິງແລ້ວ, ວິສາຫະກິດສາມາດເລີ່ມກະກຽມເອກະສານສະໝັກທີ່ກ່ຽວຂ້ອງ, ແລະລາຍງານຕໍ່ FDA ຕາມຂັ້ນຕອນສະເພາະເພື່ອຂໍອະນຸມັດ. ສຳລັບຜະລິດຕະພັນໃດກໍ່ຕາມ, ວິສາຫະກິດຈຳເປັນຕ້ອງລົງທະບຽນ ແລະ ລະບຸຜະລິດຕະພັນ.
ສຳລັບຜະລິດຕະພັນຊັ້ນ I (ກວມເອົາປະມານ 47%), ການຄວບຄຸມທົ່ວໄປແມ່ນຖືກຈັດຕັ້ງປະຕິບັດ. ຜະລິດຕະພັນສ່ວນໃຫຍ່ພຽງແຕ່ຕ້ອງການລົງທະບຽນ, ລະບຸໄວ້ ແລະ ຈັດຕັ້ງປະຕິບັດມາດຕະຖານ GMP, ແລະ ຜະລິດຕະພັນສາມາດເຂົ້າສູ່ຕະຫຼາດສະຫະລັດ (ມີໜ້ອຍທີ່ສຸດທີ່ກ່ຽວຂ້ອງກັບ GMP).
ຜະລິດຕະພັນສະຫງວນຈຳນວນໜ້ອຍຫຼາຍຈຳເປັນຕ້ອງຍື່ນໃບສະໝັກ 510 (k) ຕໍ່ FDA, ຄື PMN (ການແຈ້ງເຕືອນກ່ອນການຕະຫຼາດ));
ສຳລັບຜະລິດຕະພັນຊັ້ນ II (ກວມເອົາປະມານ 46%), ການຄວບຄຸມພິເສດຈະຖືກຈັດຕັ້ງປະຕິບັດ. ຫຼັງຈາກການລົງທະບຽນ ແລະ ການລົງທະບຽນແລ້ວ, ວິສາຫະກິດຈຳເປັນຕ້ອງຈັດຕັ້ງປະຕິບັດ GMP ແລະ ຍື່ນໃບສະໝັກ 510 (k) (ມີຜະລິດຕະພັນໜ້ອຍຢ່າງທີ່ໄດ້ຮັບການຍົກເວັ້ນ 510 (k);
ສຳລັບຜະລິດຕະພັນຊັ້ນ III (ປະມານ 7%), ໃບອະນຸຍາດກ່ອນການຕະຫຼາດຈະຖືກຈັດຕັ້ງປະຕິບັດ. ຫຼັງຈາກການລົງທະບຽນ ແລະ ການລົງລາຍຊື່ແລ້ວ, ວິສາຫະກິດຕ້ອງຈັດຕັ້ງປະຕິບັດ GMP ແລະ ຍື່ນໃບສະໝັກ PMA (ໃບສະໝັກກ່ອນການຕະຫຼາດ) ຕໍ່ FDA (ພາກທີ III)
PMN).
ສຳລັບຜະລິດຕະພັນຊັ້ນ I, ຫຼັງຈາກວິສາຫະກິດສົ່ງຂໍ້ມູນທີ່ກ່ຽວຂ້ອງໃຫ້ FDA, FDA ພຽງແຕ່ປະກາດເທົ່ານັ້ນ, ແລະບໍ່ມີການອອກໃບຢັ້ງຢືນທີ່ກ່ຽວຂ້ອງໃຫ້ວິສາຫະກິດ; ສຳລັບອຸປະກອນຊັ້ນ II ແລະ III, ວິສາຫະກິດຕ້ອງສົ່ງ PMN ຫຼື PMA, ແລະ FDA ຈະ
ໃຫ້ຈົດໝາຍອະນຸມັດການເຂົ້າເຖິງຕະຫຼາດຢ່າງເປັນທາງການແກ່ວິສາຫະກິດ, ນັ້ນຄື ອະນຸຍາດໃຫ້ວິສາຫະກິດຂາຍຜະລິດຕະພັນຂອງຕົນໂດຍກົງໃນຕະຫຼາດອຸປະກອນການແພດຂອງສະຫະລັດໃນນາມຂອງຕົນເອງ.
ວ່າຈະໄປປະເມີນ GMP ຢູ່ວິສາຫະກິດໃນຂະບວນການສະໝັກຫຼືບໍ່ນັ້ນ FDA ຕັດສິນໃຈຕາມລະດັບຄວາມສ່ຽງຂອງຜະລິດຕະພັນ, ຂໍ້ກຳນົດການຄຸ້ມຄອງ ແລະ ຄຳຕິຊົມຂອງຕະຫຼາດ ແລະ ປັດໄຈອື່ນໆທີ່ສົມບູນແບບ.
ຈາກຂ້າງເທິງ, ພວກເຮົາສາມາດເຫັນໄດ້ວ່າຜະລິດຕະພັນສ່ວນໃຫຍ່ສາມາດໄດ້ຮັບການຢັ້ງຢືນຈາກ FDA ຫຼັງຈາກການລົງທະບຽນ, ການລົງທະບຽນຜະລິດຕະພັນ ແລະ ການຈັດຕັ້ງປະຕິບັດ GMP ສຳລັບອຸປະກອນການແພດ, ຫຼື ການຍື່ນໃບສະໝັກ 510(k).
ວິທີການກວດສອບວ່າຜະລິດຕະພັນໄດ້ຖືກລະບຸໄວ້ໂດຍ FDA ຫຼືລົງທະບຽນໃນ 510k?
ວິທີທີ່ມີສິດອຳນາດພຽງຢ່າງດຽວ: ກວດສອບໃນເວັບໄຊທ໌ FDA
ເວລາໂພສ: ມັງກອນ-09-2021